细胞治疗
我国免疫细胞治疗产业发展概况(一)
免疫细胞治疗是指将体外活化和扩增的自体或异体免疫效应细胞输注患者体内的治疗方法。自2017年FDA批准全球首个CAR-T药物-诺华的Kymriah上市以来,免疫细胞细胞研发热度就一直居高不下,目前全球获批上市的CAR-T产品共有3款分别是诺华的Kymriah、凯特的YESCARTA和Tecartus。我国在免疫细胞治疗产品的研发水平仅次于美国,本文将针对目前国内获得CDE受理的免疫细胞治疗产品进行分析。
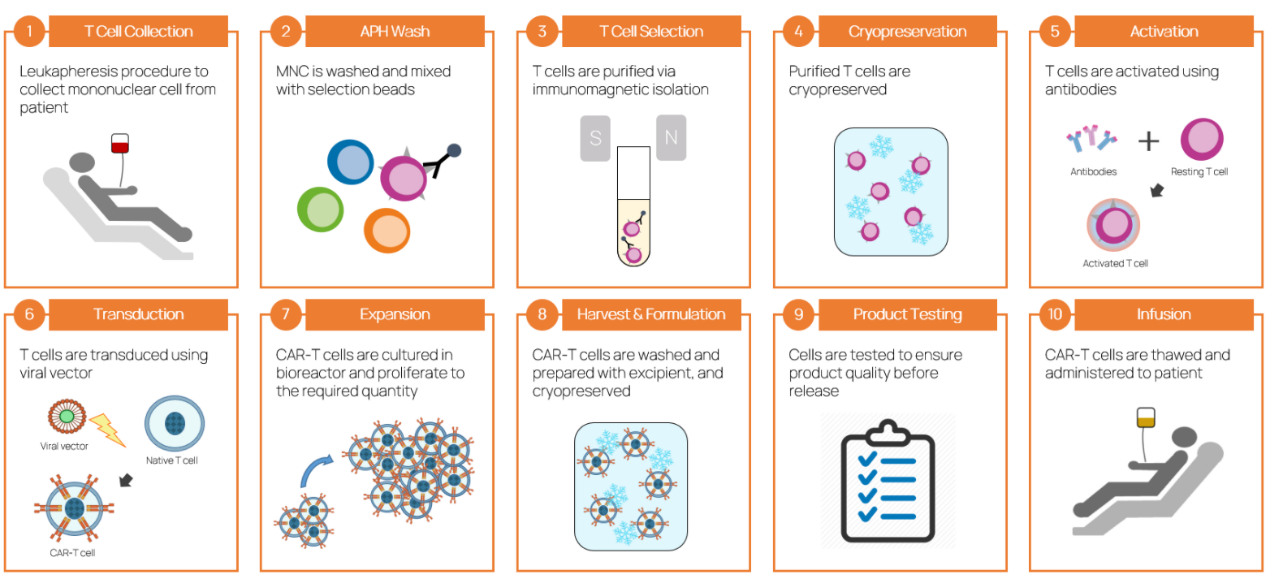
图:CAR-T细胞产品治疗过程
数据来源:根据公开资料整理
全国共有40个产品获得CDE受理,上海遥遥领先
目前我国共有35家企业的40个产品获得CDE受理,上海无论是产品数量还是企业数量均遥遥领先处于第一梯队,深圳、苏州、北京处于第二梯队,武汉、南京、重庆、天津、石家庄、广州、成都则处于第三梯队。
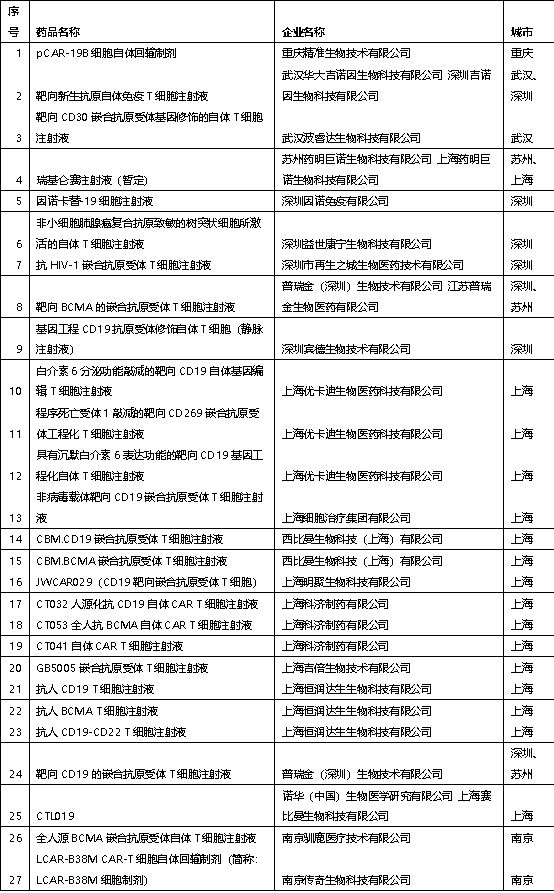

图:国内获得CDE受理的免疫细胞治疗产品
数据来源:CDE
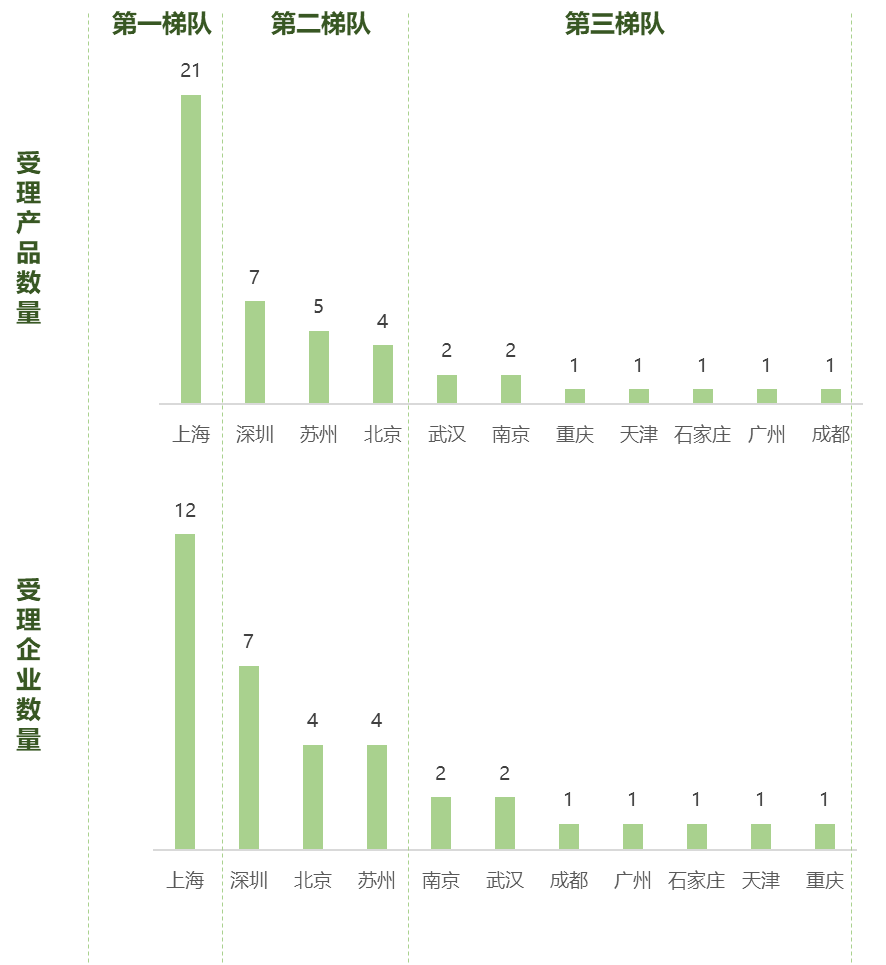
图:各城市获得CDE受理的免疫细胞治疗产品和企业数量对比
数据来源:CDE
第一梯队——上海免疫细胞治疗产业发展概况
上海获得CDE受理的免疫细胞产品数量占比超过全国一半,企业数量超过全国的三分之一,这与上海政府高度重视这一产业的发展密切相关。
上海张江地区是我国乃至全球最有潜力发展细胞治疗产业的地区之一,目前在该领域已形成先发优势。据不完全统计,目前围绕整个细胞治疗上下游产业链的企业在张江科学城超过50家。其中,细胞治疗研发企业超过20家,试剂、设备、耗材、细胞培养基等细胞装备企业超过15家,相关细胞应用评估、基因检测企业超过15家。
2019年上海市科委已正式批复同意成立上海张江细胞产业园。根据规划,张江细胞产业园将以“医谷”40万平方米空间为起点,在2019年-2022年初步形成细胞全产业链;在2023年-2026年形成从存储、研发、生产、运输、治疗到装备为一体的完整成熟的细胞全产业链;在2027年-2030年使细胞全产业链具有全球影响力。
目前上海聚集了诺华(中国)生物医学研究有限公司、复星凯特、药明巨诺、西比曼、优卡迪、亘喜生物等一大批优质企业。
复星凯特
复星凯特生物科技有限公司为复星医药集团与美国Kite Pharma(吉利德旗下公司)的合营企业,复星凯特2017年初从美国Kite Pharma引进Yescarta,获得全部技术授权,并拥有其在中国包括香港、澳门的商业化权利,该产品将被开发用于治疗两线或以上系统性治疗后复发或难治性大B细胞淋巴瘤,包括:弥漫性大B细胞淋巴瘤(DLBCL)非特指型、原发性纵隔B细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的DLBCL。
除Yescarta以外,复星凯特同时在上述地区享有Kite Pharma后续产品授权许可的优先选择权。公司2000平米的细胞治疗研发中心于2019年初落成,研发管线还包括多个 CAR-T/TCR-T 临床阶段品种和早期创新研发项目;并且与国内外肿瘤免疫治疗领域优秀研发机构合作,打造可持续的创新研发管线。
目前复星凯特引入引进得益基利仑赛注射液(拟定)(Yescarta)正处于上市前最后得行政审批阶段,有望成为我国第一个上市的免疫细胞治疗产品。另一款产品阿基仑赛注射液的临床试验申请已经在今年三月份获得CDE受理。
上海药明巨诺
由药明生物和巨诺医疗共同成立,目前共有7款在研产品,其中包括三款血液肿瘤产品和四款实体瘤产品,进展最快的瑞基仑赛注射液(暂定)目前已经处于上市申请阶段。其在上海的设立的研发中心面积2500平米,建立了包括细胞治疗过程开发、载体开发、流式细胞检测、体外细胞功能检测、分子检测在内的综合细胞治疗产品开发平台,2019年被上海市人民政府认定为"外商投资研发中心"。另外还建有约 4000 平方米符合国际cGMP和QMS标准的生产车间,可以为500名患者生产免疫细胞治疗产品。
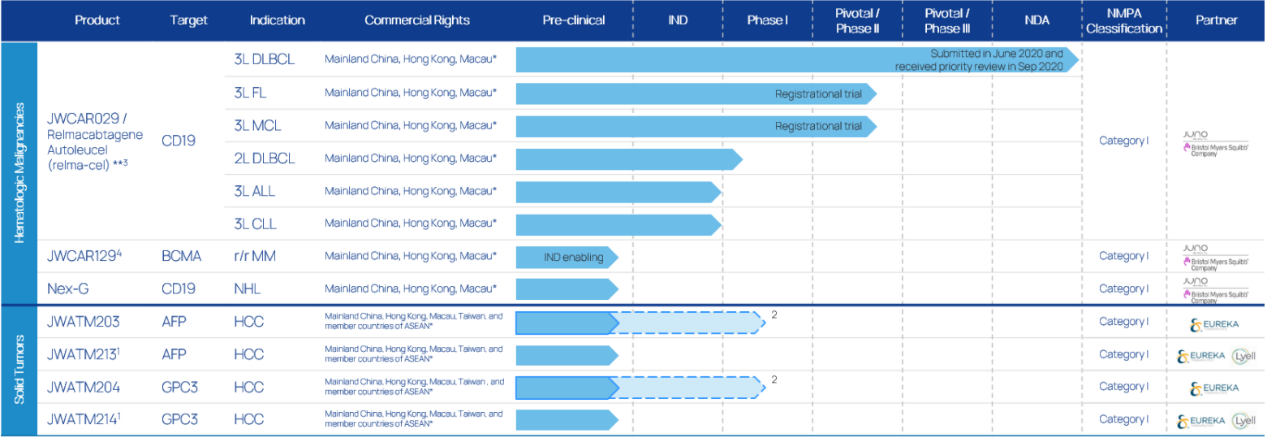
图:药明巨诺产品研发管线
数据来源:CDE
优卡迪
优卡迪成立于2015年2月,目前优卡迪不仅完成了从科研-转化-临床的技术产品闭合环的建立,而且还打造了CAR-T生产全产业链的三个完善的GMP生产和质量管理检验体系的生产基地,包括临床级质粒、慢病毒载体和CAR-T细胞的生产,并且在该生产管理体系下,与国内多家著名大型三甲医院血液科完成了1000余例CAR-T真实世界的临床研究和同情性挽救治疗,疗效达到了和国际临床试验中所报道的相一致的预期效果,但在安全性方面凸显优势。2019年,欧洲专利局相关人员在Nature Biotechnology发表了CAR-T专利申请和获批分析,优卡迪排名全球第四。同时优卡迪已获得了“中国细胞治疗企业快速成长奖”、“2019未来医疗100强-中国创新医药榜TOP100”、“2020中国医药创新企业100强”等多项荣誉,并与海南海药达成战略合作,在海南博鳌投资建设基因与细胞治疗中心。
目前优卡迪一款沉默白介素6基因的CAR-T产品已经获批临床试验,这款产品具备更低的免疫原性。另一款产品通过沉默PD-1基因,使CAR-T细胞治疗效果更好。
西比曼生物
西比曼生物科技集团公司总部坐落于上海张江,拥有6503平方米的细胞GMP生产车间,涵盖12条独立的细胞生产线,年产细胞量能够满足1万名癌症患者和1万名膝骨关节炎患者的治疗需求。公司现有干细胞治疗和免疫细胞治疗两个平台。其中免疫细胞治疗平台主要包含嵌合抗原受体T细胞(CAR-T)、基因工程改造T细胞受体T细胞(TCR-T)以及肿瘤浸润淋巴细胞(TIL)三类产品。此外公司还在无锡和北京设有细胞产品GMP生产设施。
目前公司有三款免疫细胞治疗产品进入临床试验,分别为BCMA靶点、CD19/CD20靶点的CAR-T以及一款TCR-T产品。此外公司还与诺华达成战略合作协议,负责为其在中国生产和供应CAR-T细胞治疗药物Kymriah。
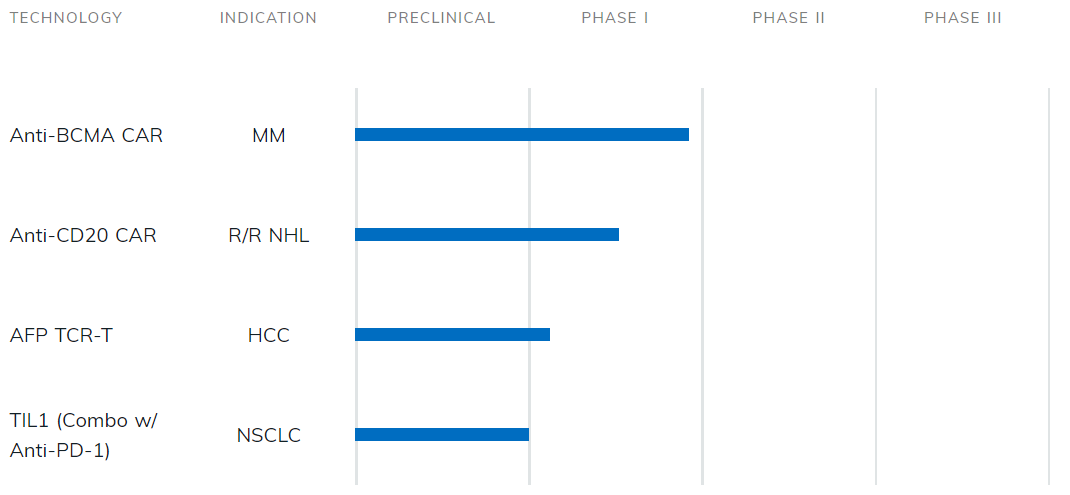
图:西比曼产品研发管线
数据来源:CDE
科济生物
科济生物医药(上海)有限公司成立于2014年10月,是中国首家专注于CAR-T细胞免疫治疗的创新型企业,也是全球知名的实体肿瘤CAR-T细胞治疗研发企业。公司现有员工130多人,硕士及博士学历员工占65%左右,拥有多名来自辉瑞、罗氏等全球顶尖生物医药公司的高管及研发人员。公司拥有包括第四代CAR-T技术在内的八十多项国内外专利技术,自主构建了研发肿瘤靶向抗体的的全人抗体库与人源化抗体技术平台,自主研发了能够覆盖大部分实体瘤及血液肿瘤的高效特异性CAR-T等候选产品。其中多个项目获得了新药创制国家十三五重大专项支持。
目前科济生物有CT032、CT041、CT053三款产品进入临床试验。其中CT041已被NMPA和FDA批准进入临床试验,将在北京大学肿瘤医院、梅奥医疗(Mayo Clinic)等多家国内外著名临床机构进行开放标签、多中心、1b期临床试验,以评估其治疗晚期胃癌、食管胃结合部腺癌或胰腺癌的安全性和有效性。CT053被NMPA授予孤儿药资格,适应症为复发难治性多发性骨髓瘤(R/R MM)。

